Un estudio científico planteó que, en algunos casos, el virus puede producir modificaciones significativas y duraderas en la inmunidad innata, que enfrenta de manera rápida a cualquier patógeno responsable de enfermedades. Cuál es el rol del Long COVID. El análisis de cuatro especialistas a Infobae
Recientemente, el director general de la Organización Mundial de la Salud (OMS), Tedros Adhanom Ghebreyesus, afirmó que el COVID-19 aún es una “amenaza sanitaria mundial”, aunque ya no está declarada como una emergencia de salud pública. “Persiste el riesgo de que surja una variante peligrosa que pueda causar un repentino aumento en los contagios y los casos mortales”, esgrimió el experto.
Y recordó que “BA.2.86 es una variante en vigilancia que tiene un gran número de mutaciones”. Es que si bien la vacunación y otras medidas de prevención fueron -y son- fundamentales para ralentizar los contagios y los casos graves, la comunidad científica aún se encuentra en estado de alerta.
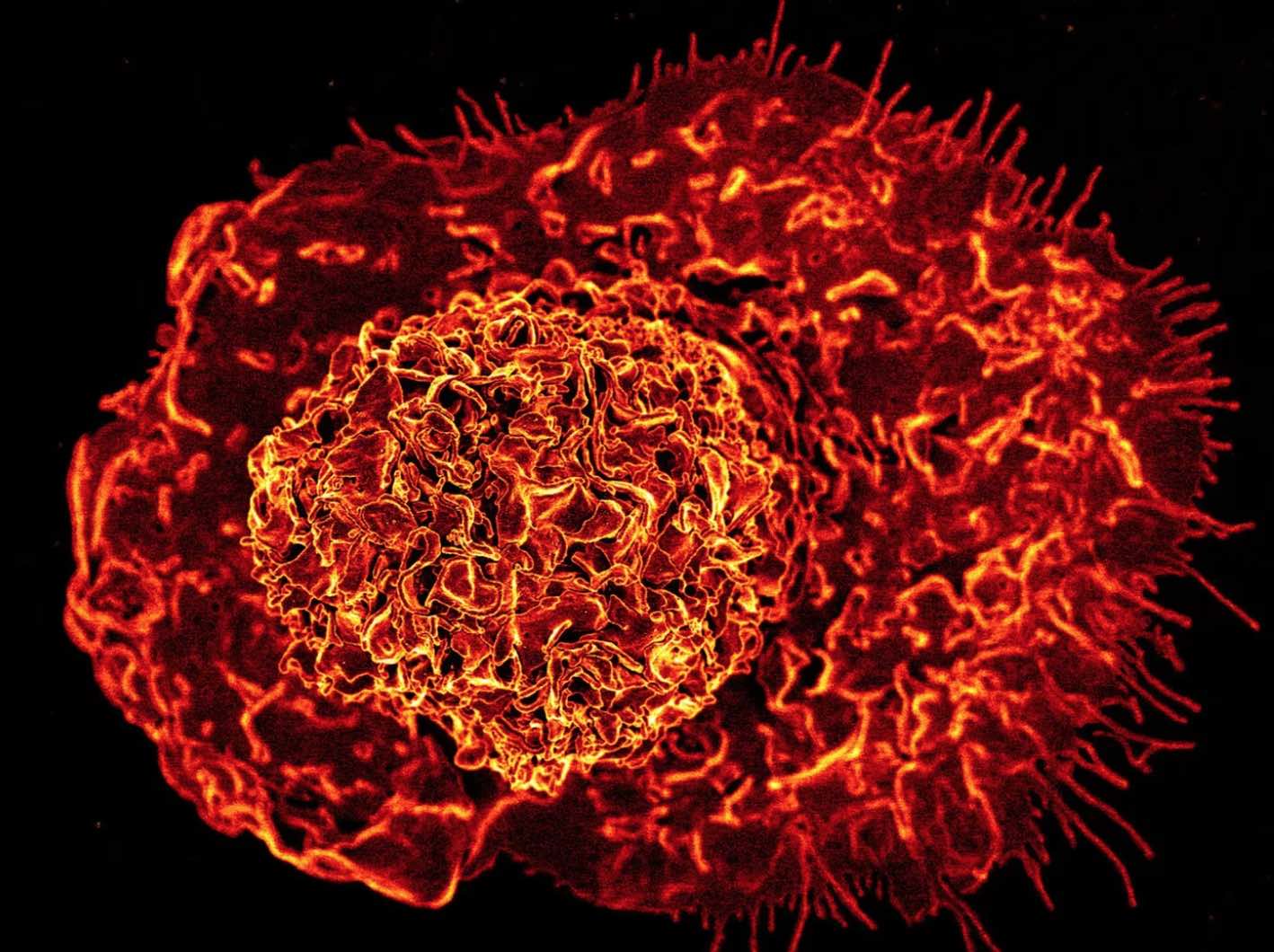
En ese sentido, recientemente, un estudio científico realizado por expertos de Estados Unidos planteó que el SARS–CoV-2 en sus formas más graves puede producir alteraciones significativas y duraderas en el sistema inmunitario innato, que se encarga de hacer frente rápidamente a cualquier patógeno que pueda causar enfermedades.
Los autores, que integran el Centro Médico Weill Cornell, en Nueva York, analizaron específicamente a las células inmunitarias innatas. Según el hallazgo, que fue publicado en la revista Cell, estas células pueden “permanecer alteradas durante al menos un año” tras una infección por coronavirus y, en consecuencia, pueden incidir en ciertos casos de Long COVID, una condición en la que los síntomas persisten por 3 meses o más.
Steven Josefowicz, uno de los investigadores a cargo del trabajo, planteó que comprender “las alteraciones en el sistema inmunitario innato podría arrojar luz sobre por qué algunas personas continúan experimentando síntomas a largo plazo después de encontrarse con el SARS-CoV-2″.
Para el estudio, Josefowicz y sus colegas analizaron muestras de sangre de 38 personas que se estaban recuperando de casos graves de COVID-19. Estas muestras se compararon con las de pacientes que se recuperaban de otras enfermedades graves y también con las de individuos completamente sanos.
Según explicaron los científicos, en lugar de extraer muestras de células madre de la médula ósea -un proceso habitual pero que puede ser invasivo y doloroso- lo hicieron desde la sangre. “Al analizar esas células madre, lo que está claro es que el sistema inmunitario cambia después de una infección grave, como la de COVID-19″, planteó Josefowicz. Y amplió: “Al sistema inmunitario le puede parecer que el COVID-19 grave es el comienzo de una infección crónica y, dado que tiene problemas para eliminar este patógeno en particular, hará todo lo posible durante un tiempo para tener una mejor oportunidad de lidiar con el virus”
Los resultados del procedimiento indicaron que las células madre de individuos que se recuperaron del COVID-19 presentaron alteraciones en la activación, o desactivación, de determinados genes. Estas modificaciones promovieron, en algunos casos, la formación de monocitos (glóbulos blancos que atacan virus y bacterias), los cuales produjeron, de acuerdo a lo observado, una mayor cantidad de moléculas inflamatorias o citocinas, que ofician como alertas que el organismo emite frente a un peligro.
“Esta dinámica podría ser la razón detrás de la afectación de múltiples órganos por el COVID-19 y de la existencia de casos con COVID prolongado”, resaltaron los autores.
Para la doctora Lindsay Lief, quien participó de la investigación, “este es el comienzo de una historia muy larga que, con suerte, abrirá nuestra comprensión de cómo las infecciones virales, y en particular COVID-19, son diferentes de un resfriado. Necesitamos entender cómo las infecciones cambian el sistema inmunológico para impactar no solo los síntomas que experimenta, sino también cómo responde a su próxima infección o su próxima vacunación”.
En tanto, Josefowicz apuntó: “Lo que esperamos ahora es que otros utilicen nuestros enfoques para vincular este tipo de cambios con diferentes resultados clínicos y estados de enfermedad. Dado que estas células sanguíneas son más plásticas de lo que la mayoría de la gente suponía que serían, ofrece la posibilidad terapéutica de devolverlas a un estado más saludable después de una infección”.
Infobae analizó los resultados de este trabajo junto a Jorge Geffner, profesor de inmunología en la UBA e investigador del CONICET. “Tras una infección por SARS-CoV-2, una vez que la persona resuelve la infección y elimina el virus, pueden persistir manifestaciones clínicas como fatiga, debilidad muscular, confusión, problemas cutáneos, fenómenos cardiovasculares, entre otras. A pesar de que el virus ya no está presente, estas manifestaciones continúan. Y la hipótesis principal del trabajo es que la causa de esto es la respuesta inflamatoria persistente”.
“Normalmente -siguió Geffner-, el cuerpo genera una respuesta inflamatoria ante cualquier infección para combatirla, pero en el caso del SARS-CoV-2, esta respuesta parece prolongarse en el tiempo de manera anómala. La razón exacta por la que esto ocurre aún está siendo establecida, pero este trabajo arroja algo de luz porque muestra que los pacientes con COVID grave se recuperan y siguen con manifestaciones inflamatorias en el organismo”.
Según analizó Geffner, “los investigadores descubrieron que en ciertas células de la médula ósea, que son precursoras de los monocitos, ocurren cambios genéticos y esto se asocia al mundo de la epigenética. En otras palabras, los cambios se transmiten a su progenie, en este caso a los monocitos. Y, aunque no haya estímulos porque ya no está la infección por COVID, estos monocitos que deberían estar ‘tranquilos’ no lo están, y liberan citoquinas inflamatorias por un defecto en su célula parental, que es la que lo originó”.
“El Long COVID no surge exclusivamente de pacientes con un cuadro severo: se ha observado que una significativa proporción de casos proviene de infecciones que fueron leves o incluso asintomáticas. Este hallazgo es relevante porque sugiere cambios genéticos que se transmiten a las células descendientes, en este caso a los monocitos. Estos cambios podrían explicar, al menos en parte, el persistente problema que tantas personas enfrentan después de la infección inicial. De acuerdo a la OMS, una vez finalizada la fase crítica de la pandemia, puede haber más de 100 o 150 millones de personas afectadas por Long COVID en el mundo”, sostuvo Geffner.
A su turno, Ricardo Teijeiro, médico infectólogo del Hospital Pirovano, le dijo a Infobae: “El sistema inmunitario innato es aquel con el que nacemos. Esta respuesta inmunológica inicial puede ser influenciada por los anticuerpos que nos brinda nuestra madre y, posteriormente, se va fortaleciendo con los contactos que tenemos con virus y bacterias a lo largo de nuestra vida. Es esencial mencionar que este sistema es vital para defendernos contra diversas infecciones”.
Según Teijeiro, los cuadros causados por el COVID o el Long COVID “representan problemáticas recientes que hemos tenido que aprender a abordar a raíz de la pandemia. Sin embargo, aunque estos síndromes presenten desafíos y complicaciones específicas, no son necesariamente más problemáticos que otras enfermedades crónicas o complicadas. Lo distintivo en este caso es que todavía estamos en proceso de conocerlos y entenderlos a profundidad”.
Por su parte, Guillermo Docena, bioquímico, inmunólogo e investigador principal del CONICET, fue en una línea similar a sus colegas en conversación con Infobae: “El sistema inmune innato tiene que ver con los mecanismos del sistema inmune que se inducen al inicio de un proceso infeccioso y generan un proceso inflamatorio para iniciar la respuesta inmune y al mismo tiempo combatir la infección. En este trabajo describieron que en pacientes con COVID-19 severo hay células de la médula ósea (monocitos) que están aumentadas en circulación y que tienen mayor poder de producir inflamación a través de una mayor capacidad de seguir produciendo citoquina pro-inflamatoria (IL-6) luego del curso la enfermedad. Esto es lo que podría generar un cuadro COVID prolongado”.
“El COVID-19 severo se debe a una inflamación descontrolada o una activación exacerbada del sistema inmune y produce un falla multisistémica. Aparentemente, esto afecta a la médula ósea y salen a circulación células pluripotenciales con capacidad de generar monocitos que secretan la citoquina pro-inflamatoria”, completó Docena.
En tanto, el doctor Alberto Cormillot planteó anteriormente a Infobae que, aunque la mayoría de las personas que contraen COVID-19 “se recuperan totalmente, otras transitan una serie de efectos a medio y largo plazo. ¿Cuáles son los síntomas más comunes que experimentan? Cansancio, niebla mental, problemas respiratorios como tos, fatiga, dificultad para hacer ejercicio. En algunos casos, también aparecen dolores musculares”.
“¿Hay personas con un mayor riesgo de desarrollar Long COVID? La Organización Panamericana de la Salud (OPS) afirma que esta condición se observa más en las mujeres o en las personas que en general tienen malas condiciones de salud antes de contraer COVID-19, y personas que padecen asma, obesidad, fuman, o vapean”, profundizó Cormillot.
Y advirtió que, en ciertos casos, el COVID prolongado “puede menoscabar la capacidad de una persona de realizar actividades cotidianas, como el trabajo o las tareas domésticas”.
Otro enfoque sobre el COVID grave y su impacto en las células inmunitarias
En 2023, investigadores de la Universidad de Linköping, en Suecia, publicaron un estudio en el cual confirmaron que cuanto más grave es la infección por COVID-19, más lenta es la recuperación de las células inmunitarias, como las dendríticas, necesarias para la activación del sistema inmunitario.
De acuerdo con sus hallazgos, publicados en la revista científica Frontiers in Immunology, seis meses después de sufrir COVID-19 grave, todavía puede observarse un impacto negativo en varios tipos de células inmunitarias.
“El principal hallazgo de nuestro estudio es que muchos tipos de células se activan 6 meses después del inicio de la enfermedad. Esto es similar a lo que ocurre con las células inmunitarias en contextos como el cáncer y el VIH, cuando hay una infección crónica en el organismo y una activación inmunitaria continua. La activación que observamos podría significar que las células inmunitarias podrían no estar activadas de forma óptima cuando se enfrentan a una nueva infección, y podrían contribuir a silenciar una respuesta inmunitaria en lugar de potenciarla”, explicó la doctora Marie Larsson, catedrática de Virología del Departamento de Ciencias Biomédicas y Clínicas de la Universidad de Linköping.
Según repasaron estos expertos, la primera vez que el organismo se encuentra con un nuevo virus como el SARS-CoV-2, el sistema inmunitario debe detectarlo. Para eso, es necesario un grupo de células denominadas células dendríticas.
Los autores examinaron muestras de sangre de 21 pacientes con COVID-19 ingresados en el Hospital Vrinnevi de Norrköping y de un grupo de control formado por 16 individuos sanos. Las muestras de sangre se tomaron en cuatro ocasiones distintas, la primera cuando los pacientes ingresaron y la última entre 6 y 8 meses después. Mediante la técnica de citometría de flujo espectral, los investigadores identificaron distintos tipos de células inmunitarias y su función probable. “Los niveles de células dendríticas eran extremadamente bajos al principio de la infección. Aunque posteriormente se recuperaron, parece que su función no se ha restablecido por completo. Las células dendríticas están más activadas de lo que deberían, y creemos que esto tiene un efecto negativo en el sistema inmunitario”, profundizó Larsson.
Bajo esta idea, los profesionales hallaron una conexión entre la gravedad de la enfermedad por COVID y el impacto en las células dendríticas: cuanto mayor era el nivel de una proteína llamada C reactiva, que aumenta rápidamente durante los procesos inflamatorios del organismo, más lentamente se recuperaban las células dendríticas.